
近日,园艺学院蔬菜生物技术与种质资源创新团队杜羽教授课题组在《Plant Biotechnology Journal》发表题为“Potato protein tyrosine phosphatase StPTP1a is activated by StMKK1 to negatively regulate plant immunity”的研究论文,该研究揭示了马铃薯酪氨酸磷酸酶StPTP1a被StMKK1激活,从而去磷酸化MPK4和MPK7负向调控植物免疫反应。
该课题组前期研究发现致病疫霉菌RXLR效应蛋白PITG20303通过靶向并稳定植物免疫负调控因子丝裂原活化蛋白激酶StMKK1促进植物感病(Du et al., 2021);进一步研究显示StMKK1通过负调控PTI(PAMP-triggered immunity)反应以及水杨酸(Salicylic acid, SA)信号通路,负调控马铃薯免疫反应(Chen et al., 2021);此外,课题组发现StMKK1的直接下游信号组分StMPK7通过磷酸化并稳定RNA结合蛋白StUBA2a/b,从而激活SA信号通路正调控植物对疫霉菌的抗性(Zhang et al., 2021;Li et al., 2022)。本研究在此前期基础上,进一步揭示了马铃薯StMKK1-StMPK4/7级联的调控机制。
该研究通过酵母双杂交筛选,鉴定到一个与StMKK1互作的候选蛋白马铃薯酪氨酸蛋白磷酸酶StPTP1a,通过酵母双杂交技术(Yeast Two Hybrid,Y2H)、免疫共沉淀技术(Co-immunoprecipitation assay,Co-IP)以及荧光素酶互补成像技术(Luciferase complementary imaging technology,LCI)验证了StMKK1和StPTP1a之间的相互作用;进一步研究发现StPTP1a负向调控马铃薯免疫反应,抑制SA信号通路相关基因的表达。此外,酶活性试验确认了StPTP1a是一种功能性磷酸酶,磷酸化试验表明其可以被StMKK1磷酸化而激活;质谱分析成功鉴定到StPTP1a被StMKK1磷酸化的三个位点Ser-99、Thr-223和Thr-290,进一步的三位点突变体不能被StMKK1激活,表明这些位点对StPTP1a的催化活性至关重要。
研究者还发现StPTP1a与StMKK1下游信号组分StMPK4/7互作并将其去磷酸化,通过在本氏烟草中分别共沉默NbPTP1a和NbMPK4或NbPTP1a和NbMPK7并进行接菌试验,发现与NbMPK4/7共沉默后,NbPTP1a沉默引起的植物对致病疫霉菌(Phytophthora infestans)的抗性增强表型丧失,进一步确认了NbMPK4和NbMPK7在StPTP1a的下游发挥作用;此外,western blot 结果表明StPTP1a在PTI后期被磷酸化和稳定,进而去磷酸化StMPK4和StMPK7。
综上所述,研究结果表明,在PTI被引发的初期StMKK1磷酸化并激活StMPK7/4,而在PTI后期,StMKK1通过磷酸化并激活StPTP1a,激活后的StPTP1a通过去磷酸化MPK7/4而抑制二者功能(图1)。该研究解析了StMKK1通过介导StPTP1a的激活,实现了对StMPK7/4活性的精确调控,从而使植物避免过度激活免疫反应,调节了植物生长和防御的平衡。
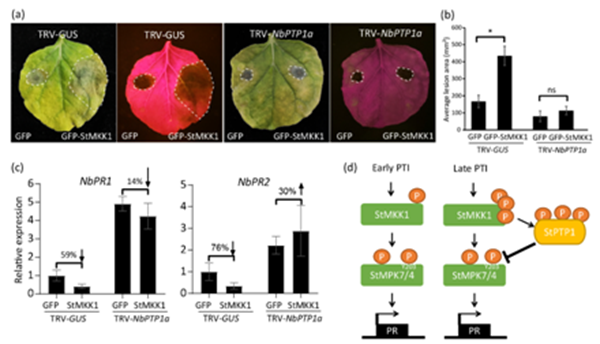
图1 StMKK1依赖StPTP1a抑制植物免疫
园艺学院杜羽教授为该论文的通讯作者,博士研究生李芳芳和陈小康为共同第一作者。该研究得到国家自然科学基金(32072401)、中国高校科学基金(2452018028,2452017069)以及国家外国专家局高校创新学科人才引进计划(111计划)(#B18042)等项目的资助。
原文链接:https://onlinelibrary.wiley.com/doi/epdf/10.1111/pbi.13979
编辑:张晴
终审:徐海