
近日,我院动物营养与健康养殖科技创新团队在《Advanced Science》发表题为“Role of FLCN phosphorylation in insulin-mediated mTORC1 activation and tumorigenesis”的研究论文。研究生王国艳、陈蕾、雷新建副教授为论文的共同第一作者,邓露副教授、孟通副研究员(上海市第一人民医院)、姚军虎教授为共同通讯作者。
感应营养信号是机体健康和动物高效生产的关键。mTORC1作为经典的营养感应器,能够感应并整合氨基酸、生长因子和葡萄糖等信号。经典理论认为胰岛素介导的AKT-RhebGTPase信号轴仅对mTORC1的活性起决定性作用,但本研究发现此信号轴对mTORC1的定位同样至关重要。
先前关于胰岛素的研究主要集中在其促进mTORC1的激酶活性方向,而本研究表明,胰岛素的刺激能够显著促进mTORC1在溶酶体上的定位,通过对mTOR通路中具有重要作用的蛋白进行筛选,发现胰岛素的刺激能够促进FLCN Ser62位点的磷酸化,并鉴定了促进FLCN Ser62位点磷酸化的激酶—AKT。
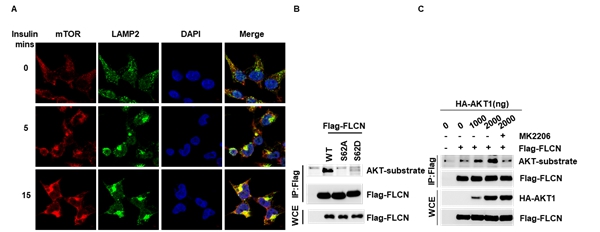
图1胰岛素促进mTORC1的溶酶体定位及AKT介导FLCN的磷酸化修饰
为了检测FLCN的磷酸化修饰对mTORC1溶酶体定位的影响。作者通过CRISPR-Cas9技术构建了FLCN-S62A及FLCN-S62D定点敲入细胞系,发现FLCN的磷酸化水平显著影响mTOR与LAMP2的共定位,并增强细胞对胰岛素的敏感性,即FLCN的磷酸化能明显促进mTORC1的溶酶体定位及胰岛素介导的mTORC1的活化。
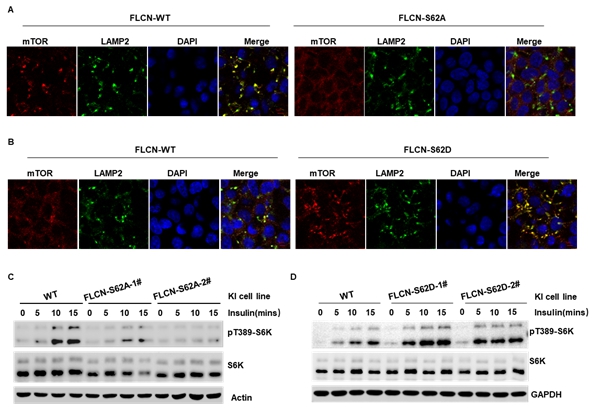
图2 FLCN的磷酸化调控mTORC1的溶酶体定位及mTORC1的活化
肠上皮细胞是养分吸收的主要部位,其动态更新速率直接决定养分的吸收效率。通过FLCN-S62A及FLCN-S62D定点敲入细胞系,发现FLCN的磷酸化修饰能正向调控肠上皮细胞的增殖。结合免疫荧光试验,发现这一修饰还能显著抑制肠上皮细胞自噬,即FLCN Ser62位点的磷酸化可调控肠上皮细胞的动态更新过程。
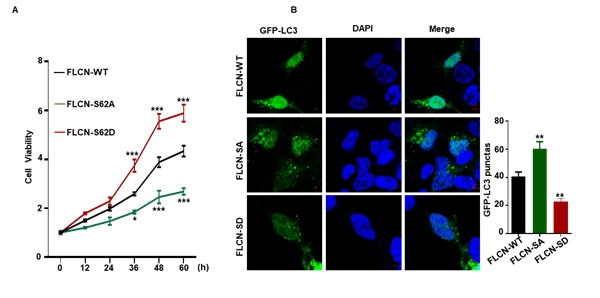
图3 FLCN的磷酸化调控肠上皮细胞的增殖和自噬
本研究揭示了FLCN可感应胰岛素信号的新功能,鉴定了Ser62是FLCN感应胰岛素信号的磷酸化位点,阐明了FLCN Ser62位点的磷酸化是胰岛素调控mTORC1溶酶体定位和活性的重要机制。该研究还揭示了FLCN的磷酸化在肠上皮增殖及自噬中的重要作用,为通过营养调控手段改善肠道健康、促进营养物质的高效吸收提供了潜在靶点。
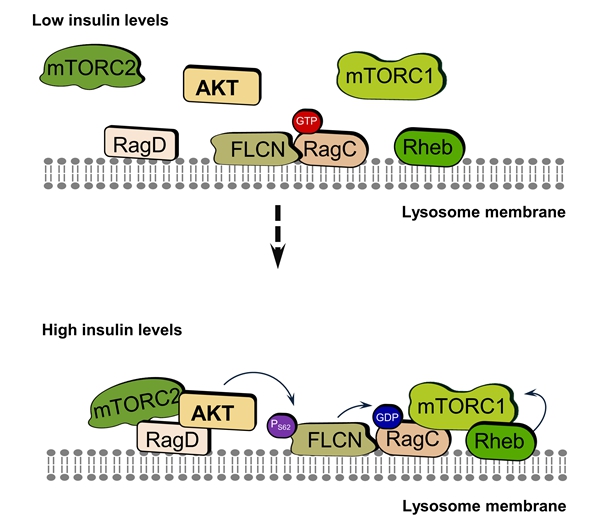
图4 FLCN磷酸化在胰岛素介导的mTORC1激活中的作用
该研究在国家自然科学基金(32070782,32100578,82173168,32072761,32102569);广东省基础与应用基础研究省企联合基金(2021A1515220036)等项目的资助下完成。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/advs.202206826
编辑:张晴
终审:徐海