
为推动脓毒症肌肉萎缩的研究,动物科技学院吴江维教授牵头联合多家高校、企业、医院及研究所展开了深入合作,成功创制了首例脓毒症诱导肌萎缩猪模型,并发现转录因子ZBED6是治疗该类疾病的潜在新靶标。近日,该成果以“Loss of ZBED6 protects against sepsis-induced muscle atrophy by upregulating DOCK3-mediated RAC1/PI3K/AKT signaling pathway in pigs”为题发表于著名杂志《Advanced Science》。博士研究生刘欢、中科奥格生物科技有限公司首席科学家潘登科、空军军医大学第二附属医院黎璞副主任医师及北京畜牧所王丹丹博士为论文共同第一作者,吴江维教授、四川农业大学李明洲教授、北京畜牧所蒋琳研究员和空军军医大学第二附属医院姚立农主任为论文共同通讯作者。
作为我国重要的农业动物,猪肉消费长期以来占据肉类消费的60%以上,对提高国民生活质量至关重要。然而,除了其农业价值外,猪在解剖学、生理学、免疫学以及基因组等方面与人类高度相似,因此在医学领域拥有巨大的潜力,成为重要的医学模型和理想的人类器官移植供体。脓毒症是一个全球性的公共卫生安全问题,肌肉萎缩是脓毒症患者最常见的并发症之一,其治疗消耗大量的医疗资源并产生高额的医疗费用,给患者的家庭和社会带来沉重的经济负担。然而,近几十年来,关于脓毒症肌肉萎缩的研究成果未能有效应用于临床,主要难题之一是缺乏合适的动物模型推动基础研究的转化应用。
该项工作首创新型盲肠结扎穿刺(CLP)模型的手术方案,创制新型猪脓毒症模型,不仅成功降低了猪作为脓毒症模型的死亡率,并维持了脓毒症状态,再现了患者肌萎缩症状,重现了人类脓毒症的发生发展全过程。该模型的建立填补了脓毒症肌萎缩大动物模型研究领域的空白,这一突破性进展有望深入探究脓毒症肌萎缩发生与发展的过程,并解析其病理机制,推动脓毒症肌萎缩药物的研发和诊疗方案的研究。
研究中综合运用影像学、病理组织学及多种分子生物学手段对脓毒症肌萎缩病人和猪模型样品进行跨物种高纬度联合分析,发现ZBED6基因与脓毒症肌萎缩高度相关。借助该模型揭示ZBED6基因缺失抵抗脓毒症肌萎缩的分子机制,发现ZBED6是脓毒症引起肌肉萎缩的潜在治疗靶点,靶向该基因有望改善脓毒症肌萎缩。
该项研究成果不仅在医学领域具有重要意义,同时凸显了我国在医学研究方面的领先地位,也将为提高医疗水平、减轻患者痛苦以及促进社会健康事业的发展带来积极的影响。通过对ZBED6基因的挖掘,团队为猪肉质性状改良的分子靶标以及肌萎缩疾病治疗的研究提供重要线索,为猪品种改良及人类疾病研究等“一猪两用”工作,带来新的应用前景。
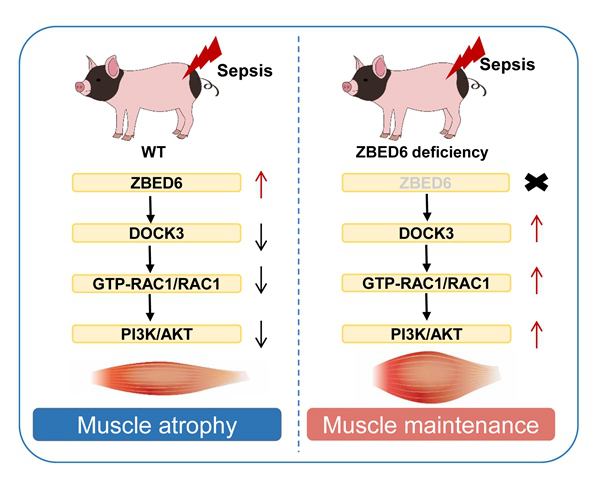
ZBED6基因缺失抵抗脓毒症肌萎缩的分子机制模式图
本研究得到国家重点研发计划、国家自然科学基金、陕西省创新人才推进计划及四川省重点研发计划等项目资助。
编辑:张晴
终审:徐海